開發進度
LT3001已順利完成兩項2b期臨床試驗,試驗範圍包括美國、歐盟、中國大陸及台灣。結果顯示,LT3001具有明顯療效,且安全性良好,未出現出血副作用,治療時間窗更可延長至發病後24小時內。
順藥目前正規畫LT3001在美國及中國大陸市場的雙軌開發策略,將針對目前缺乏治療選擇的急性缺血性腦中風患者進行第三期臨床試驗,以擴大潛在治療族群。LT3001的中國獨家開發與銷售權已受權上海醫藥集團。
人體試驗列表
-
臨床階段 :
第一期 (LT3001-101)
-
試驗簡述 :
Single dose on healthy volunteers
-
地區 :
美國
-
狀態 :
已完成
-
連結 :
-
臨床階段 :
第一期 (LT3001-103)
-
試驗簡述 :
Multiple dose on healthy volunteers
-
地區 :
中國
-
狀態 :
已完成
-
連結 :
-
臨床階段 :
第一期 (LT3001-105)
-
試驗簡述 :
Multiple dose on healthy volunteers
-
地區 :
美國
-
狀態 :
已完成
-
連結 :
-
臨床階段 :
第二a期 (LT3001-201)
-
試驗簡述 :
Single dose on AIS patients
(within 24 hrs)
-
地區 :
美國/台灣
-
狀態 :
已完成
-
連結 :
-
臨床階段 :
第二期 (LT3001-202)
-
試驗簡述 :
Multiple dose on AIS patient
(within 24 hrs)
-
地區 :
中國
-
狀態 :
已完成
-
連結 :
-
臨床階段 :
第二期 (LT3001-203)
-
試驗簡述 :
Multiple dose on AIS patient
(within 24 hrs)
-
地區 :
美國/台灣
-
狀態 :
進行中
-
連結 :
-
臨床階段 :
第二期 (LT3001-205)
-
試驗簡述 :
Multiple dose on AIS patient
(within 24 hrs)
-
地區 :
美國/台灣/歐洲
-
狀態 :
已完成
-
連結 :
LT3001 相關文獻
Jiang, Y., Ji, Y., Zhou, I. Y., et al. (2024). Effects of the new thrombolytic compound LT3001 on acute brain tissue damage after focal embolic stroke in rats. Translational Stroke Research, 15, 30–40. https://doi.org/10.1007/s12975-022-01107-3
Chao, A. C., Lee, T. H., Pettigrew, L. C., Hannawi, Y., Huang, H. Y., Chi, N. F., Chan, L., Chen, P. L., & Devlin, T. (2024). Intravenous odatroltide for acute ischemic stroke within 24 hours of onset: A phase 2, multicenter, randomized, double-blind, placebo-controlled study. Drug Design, Development and Therapy, 18, 2033–2042. https://doi.org/10.2147/DDDT.S460831
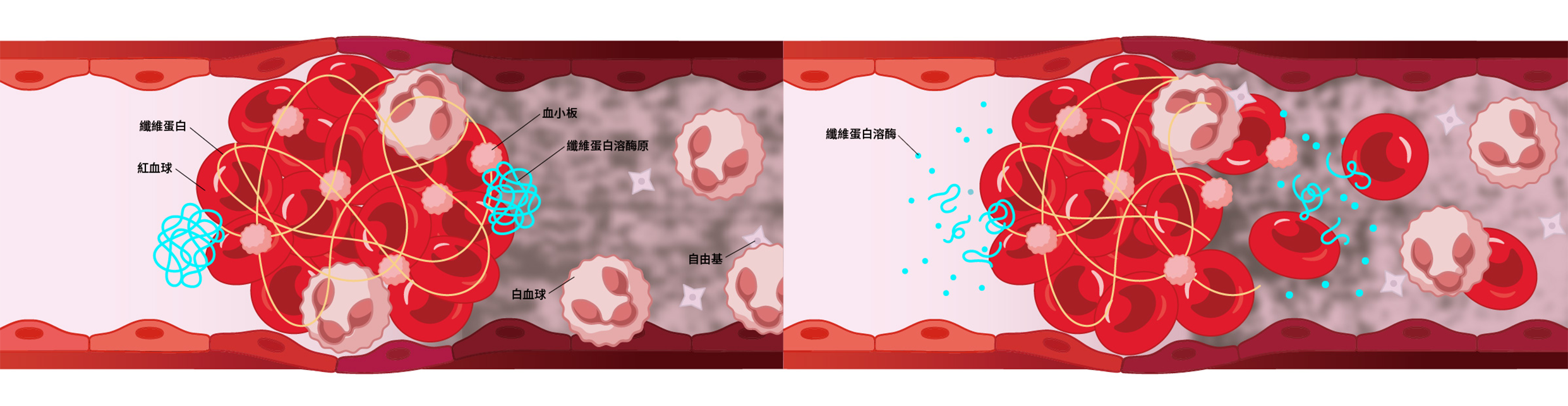
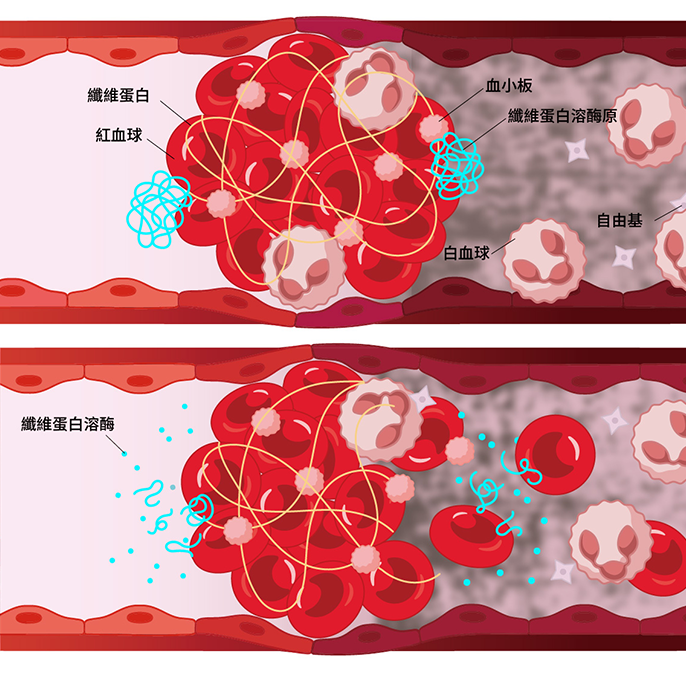 1
1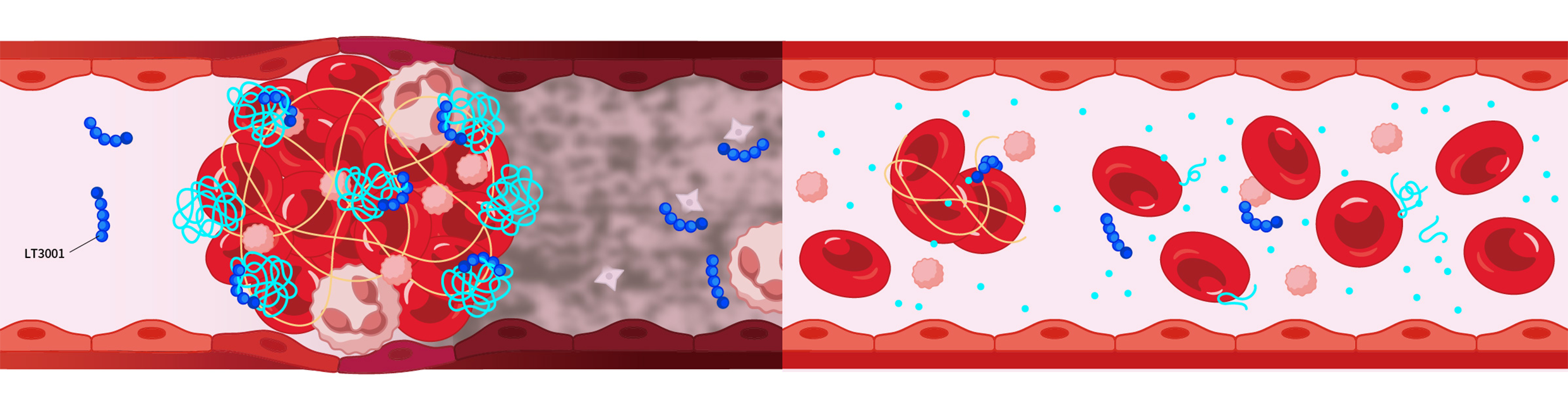
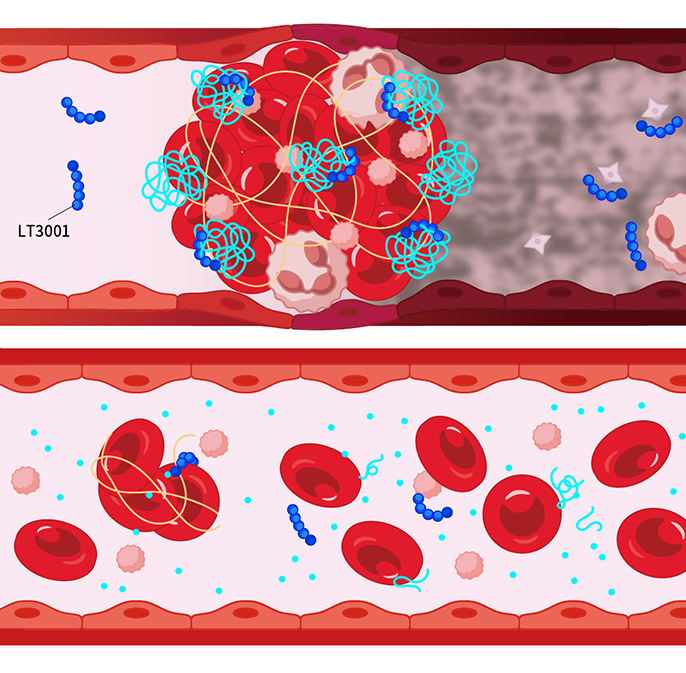 2
2





